Image
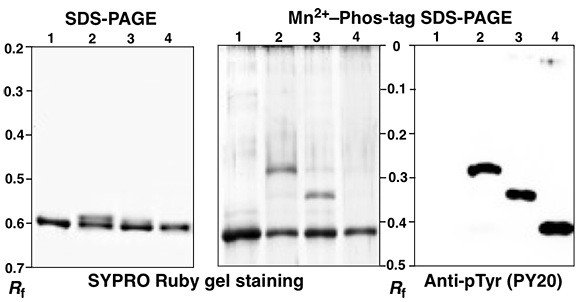
各レーンは,以下のチロシンキナーゼによる,Tau の in vitro kinase assayです。
1. kinase なし, 2. Abl, 3. MET, 4. FYN
Tau タンパク質には5つのチロシンTyr-18, -29, -197, -310, -394があります。
FYNはTyr-18をリン酸化することが報告されています。
Mn2+–Phos-tag SDS-PAGE で,Abl,MET によってリン酸化されたものが
シフトアップしているのがわかります。
FYNはシフトアップバンドが見られません。
抗リン酸化チロシン抗体(PY20)によるWB より,
3種類のチロシンキナーゼによってTauはチロシンリン酸化されることがわかりました。
Abl とMETについては,シフトアップバンドがリン酸化物ですが
FYNについてはリン酸化していても,シフトアップしないことがわかりました。
Abl とMET によるシフトアップバンドの質量分析から
AblはTyr-394 を,MET はTyr197をリン酸化することがわかりました。
この実験は,次の2つのことを示しています。
Phos-tag SDS-PAGE では分子内のリン酸化数が同じでも
リン酸化部位が異なれば,異なる移動度を示すこと
Mn2+–Phos-tag SDS-PAGE ではリン酸化していても
シフトアップしない例があるということ
後者については,Zn2+–Phos-tag SDS-PAGEで,その問題点が解決されます。
Related data
Tau kinase assay(Ser/Thr kinase)
.png)